はじめに 生物学的まとめ。前回非常に思弁的だったので、そのカウンター。
うつ病は辛いことが続いて、ストレスとなり発症するという仮説がある。「ストレスのせいでしょう」と言われたりすることは多い。あるいはセロトニン選択的再取り込み阻害剤 SSRI が効くことからうつ病はセロトニンが足りなくて発症するという仮説があり、それはとても理解しやすいし、ほぼ常識とさえなっている。
しかし、最初のうつ病や躁うつ病の発症にはストレス性の刺激が関与していることが多い(報告によって 45%から 90%とばらつくが、70%くらい)が、うつや躁の病相を繰り返しているうちに、ストレス性の刺激のある場合の再発が明らかに減少し(10%から 50%とばらつくが、30%くらい)、自然にうつ病相や躁病相を起こす、いわゆる「自生性」があることが臨床的には明らかである(表 1)。しかも、そのストレス性の出来事は親族や友人の死、過労や仕事の失敗ばかりでなく、本来よろこばしいはずの昇進や結婚などのこともあることが明らかにされている。
昇進や結婚などうれしいことでもうつになることをどう説明するかについて、私のMAD-KON-Theoryは有効である。
セロトニンの欠乏に関しても、セロトニン前躯体によるうつ病治療の効果が必ずしも確認されておらず、また、低トリプトファン飲食料などの負荷で、血中の遊離トリプトファン濃度を低下させ、脳内のセロトニンの合成低下を引き起こしても、未治療のうつ病で増悪するのは 25%程度であり、半数は不変、残りは軽快するという報告がなされている。トリプトファン水酸化酵素タイプ 2 の遺伝子多型でセロトニン合成低下に関連する一塩基多型(SNP)をもつうつ病は全体の 10%程度であることが最近報告され、セロトニンの合成低下で説明できるうつ病はごく一部である可能性が高いことになる。
このように、常識であると捉えられていることであってもそう単純ではないとすると、いったいうつ病についてどこまでが確実なことといえるのであろうか ?
そのようにして問題を整理することはとても大切ですね。仮説を考えるとして、何を説明すればよいのか。
がんや心筋梗塞などの重篤身体疾患の罹患というストレスに曝されてうつ病を起こす症例は大体 5 ~ 10%、不安や軽うつを伴う適応障害が 20%くらいであり、残りの大部分の方々はその生命の危機に直面しても次第に適応して闘病されるようになるので、ストレスに曝されてうつ病を発症するのは一部の方であり、うつ病の発症脆弱性をもつ個人にストレスが作用するためではないかと考えられる。
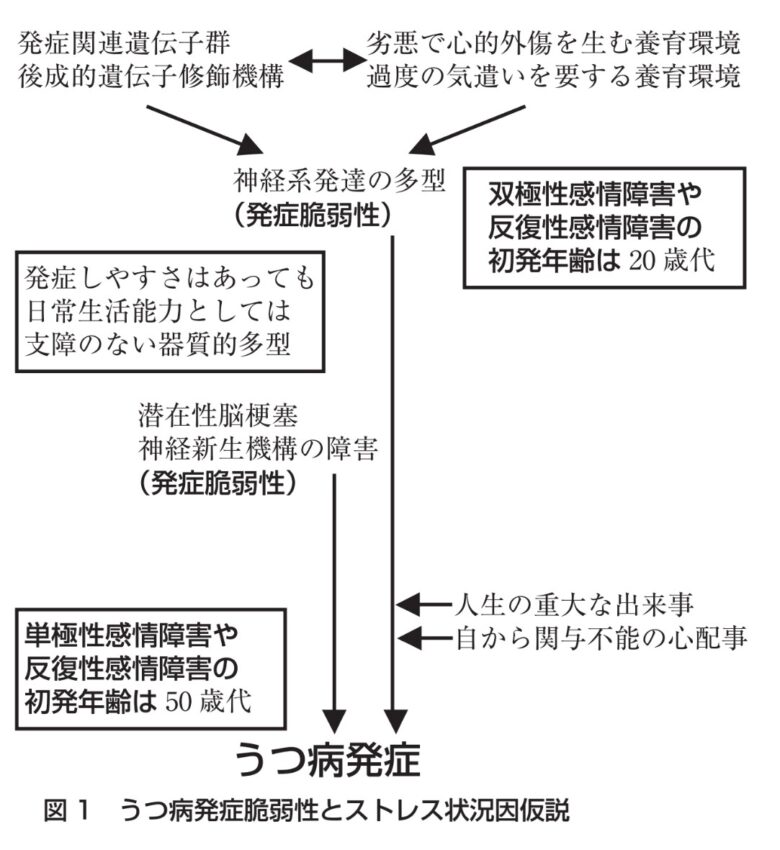
では、その初発の発症脆弱性についてはどのようなことが明らかになっているのであろうか? 平成 5 年の厚生省研究班の共同研究による調査データの解析では、全国の大学病院や総合病院精神科に入院した感情障害約 300 症例は双極性感情障害が約 100 症例、単極性反復型約 100 症例、大うつ病シングルエピソード約100 症例であったが、初発年齢の分布をみると、双極性感情障害が 20 歳代にピーク、単極性反復型は 20 歳代と 40 歳代にピーク、シングルエピソードは 50 歳代にピークがあることが明らかにされている。したがって図 1 に示したように、遺伝的な要因や養育環境因など神経系の発達に関連する発症脆弱性の形成や、加齢に伴う神経系の退行に関連する発症脆弱性の形成が仮説として考えられる。ここではこのうつ病発症脆弱性について概説する。
「初発年齢の分布をみると、双極性感情障害が 20 歳代にピーク、単極性反復型は 20 歳代と 40 歳代にピーク、シングルエピソードは 50 歳代にピーク」これは仮説が説明すべき事項だ。
ーーーーー
表 1 躁うつ病や単極性うつ病の初発と二回目以降の症状出現直前のライフ・イベントの頻度
著者 対象疾患 初発 二回目以降
Perris 単極性うつ病 62 % 19 %
Ambelas 躁病 58 % 24 %
Dolan 単極性うつ病 62 % 29 %
Ghaziuddin 単極性うつ病 91 % 50 %
Cassano 単極性うつ病 66 % 49 %
Okuma 双極性感情障害 45 % 13 %
Angst 単極性うつ病 60 % 38 %
Matussek 単極性うつ病 44 % 19 %
ーーーーー
2。 うつ病における視床下部-下垂体- 副腎皮質系機能調節障害
種々のストレス性の刺激に対する共通の生体反応としての視床下部 – 下垂体 – 副腎皮質系(hypothalamo-pituitary-adrenal axis: HPA 系)が Selye によって注目されるようになったが、この系はグルココルチコイド受容体を介したフィードバック機能による閉鎖系となっており、ストレス性の刺激に対する HPA 系の反応が過剰とならないようになっている。ところが、うつ病ではこの HPA 系の反応に対するフィードバック機能が減弱していることがわかってきている。健常者に長時間作用する合成ステロイドのデキサメサゾン(DEX)を前夜に投与してグルココルチコイド受容体を刺激しておくと、翌朝、副腎皮質刺激ホルモン(ACTH)の分泌抑制が起こるので、コルチゾール濃度が低下し、午後に副腎皮質刺激ホルモン遊離促進ホルモン(CRH)を注射しても(DEX/CRH 試験)、ACTH やコルチゾール分泌反応はほとんど起こらない。
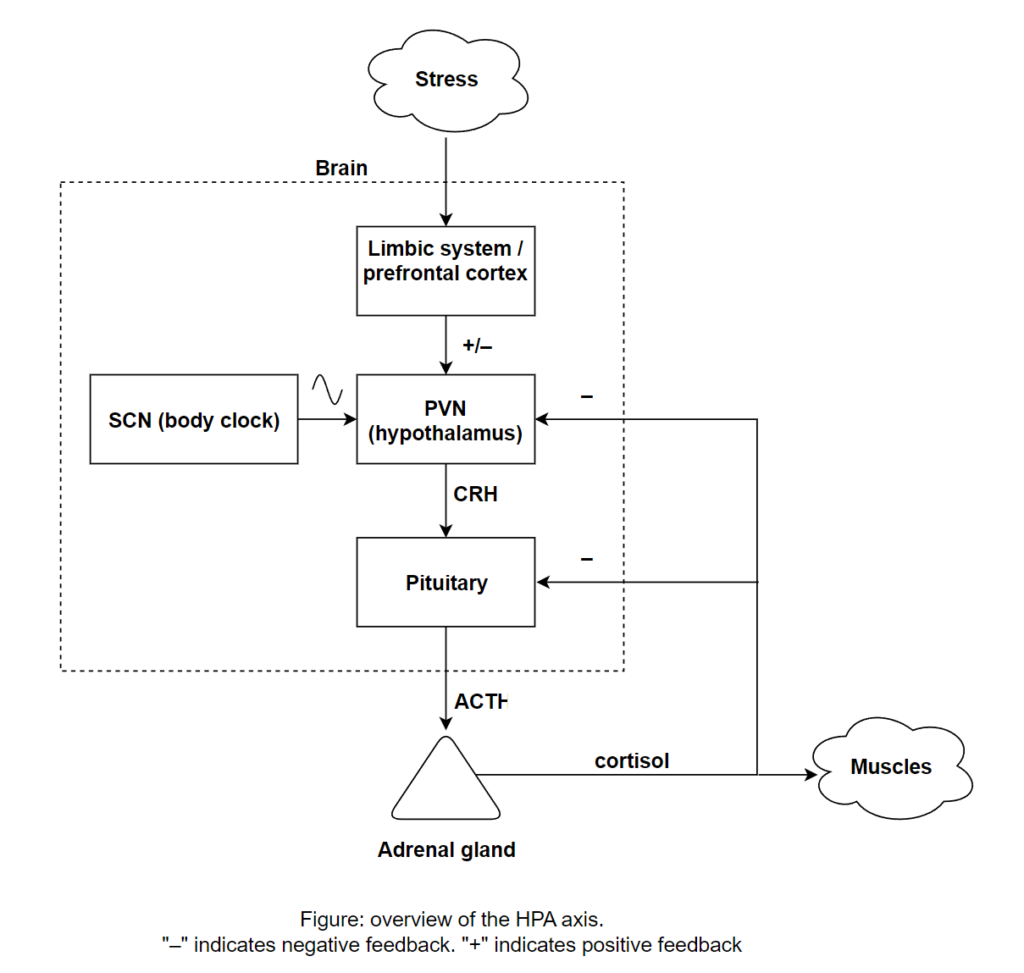
しかし、約 75%のうつ病症例では DEX/CRH 試験でコルチゾール濃度が著明に増加し、フィードバック機能の低下が明らかである。抗うつ薬療法が奏功すると、コルチゾールの過剰反応はほぼ正常化する。これらの結果は国内の多施設共同研究によっても確認されている。また、抗うつ薬では奏功しなかったうつ病患者ではコルチゾール濃度の著明な増加が持続し、電気刺激療法を施行して、うつ症状が軽快すると、HPA 系の過剰に対するフィードバック機能低下も同様に正常化する。したがって、この感情障害における HPA 系の過剰に対するフィードバック機能低下はうつ症状の改善とともに正常化する状態依存的な性質をもつうつ病の生物学的マーカーと考えられている。
25%はどのように説明されるのだろう。
また、抗うつ薬が海馬におけるグルココルチコイド受容体を増加させる作用を有し、HPA 系を抑制して、室傍核の CRH 合成を抑制することが知られており、この状態依存性は抗うつ薬の作用に基づくことが明らかにされている。しかし一方、この HPA 系の制御機能低下は非発症のうつ病家族にも軽度ながら認められることが報告されているので、うつ状態非依存的な素因的マーカーである可能性があり、ストレスに誘発されるうつ病の発症脆弱性のひとつであると考えられている。前述のわれわれの報告の中でも、抗うつ治療前の HPA 系の非抑制群は抑制群に比較して内側前頭前野(ブロードマン 10 野、Diorio らによりHPA 系の調節に関与する前頭前野の脳部位として報告されている)の低活動がより著明であるが、抗うつ療法でうつ症状が軽快し、HPA 系が抑制へと正常化しても、この BA10 野の低活動は持続することを明らかにしており、状態非依存的異常を呈する脳部位のひとつである可能性を示した。
このあたりは別の解釈の余地もありそうだ。
このフィードバック機能の低下という脆弱性を持った個体がストレスに曝されて、HPA 系の機能亢進が持続し、高コルチゾール血症となると、通常の血中レベルのコルチゾールでは部分的にしか占拠されていないグルココルチコイド受容体が刺激され続けることになり、摂食行動の抑制、意欲的行動の抑制、悲哀感の増加を引き起こすとともに、嫌悪体験の記憶の促進、嫌悪刺激に対する過剰反応を引き起こすことになると考えられる。
一方、グルココルチコイド受容体が刺激され続けると、種々の遺伝子発現が調節されることになる。例えばアミン受容体や細胞内情報伝達系ならびに核内転写制御に影響し、アミン神経伝達が変化し、その結果脳由来神経栄養因子(BDNF)の遺伝子発現も変化し、神経の樹状突起のスパインの数やシナプス数に影響することになって、前頭前野背外側部 – 内側前頭葉 – 扁桃体―海馬などの神経ネットワーク機能が変化し、感情障害を発症すると推測されている。
われわれの検討では ACTH の反復投与によりラット前頭皮質のセロトニン -2A(5-HT-2A)受容体密度の増加が起こり、副腎摘出でその効果は阻止され、また、コルチコステロンの反復投与でも 5-HT-2A 受容体密度の増加が起こる。
C6 グリオーマ細胞は 5-HT-2A 受容体 -フォスファチジル・イノシトール代謝 – カルシウム動員系を有しており、培養メディウムにデキサメサゾンを数時間添加すると、セロトニン刺激性の細胞内カルシウム増加反応が亢進することも明らかにされている。一方、ラット海馬の 5-HT-1A 受容体密度は副腎摘除で増加し、コルチコステロンの補充で低下することが明らかにされている。さらに、背側海馬の5-HT-1A 受容体刺激はうつ病モデルとして注目される学習性無力の成立を阻害することが明らかにされるとともに、大うつ病性障害の海馬での 5-HT-1A 受容体発現が低下していることが PET 画像解析で明らかにされている。このようにセロトニン神経伝達は副腎皮質ホルモンの調節を受けており、興味深いことに、5-HT-1A 受容体と 5-HT-2A 受容体とがちょうど逆の調節を受けていることが明らかにされてきている。
セロトニン神経伝達と副腎皮質ホルモン系の関係はさらに複雑そうである。しかし、複雑になるものには、仮説としての魅力が乏しい。
また、抗うつ薬の分子作用機序として、前述したように海馬におけるグルココルチコイド受容体発現を増加させ、HPA 機能亢進を抑制することが動物実験で知られている他、プロテインキーナゼ C の活性化とCREB のリン酸化の亢進に基づく BDNF mRNA の発現増加が知られており、神経細胞の生存維持や神経の可塑性を促進させるが、海馬の 5-HT-2A 受容体刺激はBDNF mRNA の発現を抑制することが明らかにされている。実際、感情障害のための高コルチゾール濃度暴露により感情障害患者の海馬の細胞構築が変化し、海馬容積が低下していることを示す証拠が集積しつつあり、特に、初発年齢が低いほど、反復する病相回数が多いほど、未治療の期間が長いほど、幼児虐待の既往のあるものほど海馬容積の低下が著明であることが報告されている。
3。 がん罹患ストレスとうつ病や適応障害の発症予測
平成 16 年に閣議決定された健康寿命延長 10ヵ年計画の達成の有力な戦略の一つがうつ病の早期発見と根治的治療、できれば発症予防である。多くの中高年者ががんや心筋梗塞、糖尿病などに罹患後にうつ病や不安・抑うつを伴う適応障害を併存すると、QOL や ADL の低下を起こし、まさしく健康寿命を損なうことになるので、うつ病の早期発見と根治的治療法の確立が最も求められている。実際、早期がんの患者でも、進行がん患者や終末期がん患者でも大うつ病や不安・抑うつを伴う適応障害を 20~30%が発症することが報告されている。
がん患者の精神症状発現に関する前方視的な研究を紹介する。精神科受診を意図したり希望したりしていないがん患者の同意と協力により行った研究であるので、できるだけがん患者に負担をかけないことを前提にこの前方視的研究を計画した。したがって、間接的にしか精神症状を評価できず、また、うつ病をおこしやすい可能性の高い群の方々がこの研究への参加に同意せず、追跡調査に含まれていない可能性が大きいという研究上の制約があることは否めない。
精神科的既往の無いがん患者が転移病巣検索や治療効果判定のために全身 FDG-PET 検査を受ける際に、研究協力を依頼し、117 名の患者から同意が得られた。そ の が ん 患 者 に「Hospital Anxiety and Depression Scale (HADS)」という自記式の不安や抑うつのアンケートに答えてもらうとともに、精神科医による面接を行ってその時点では精神症状を呈していないがん患者を 1 年間追跡調査した。初回の HADS 得点が 14 点以下で、うつ病や適応障害がその時点で否定され、脳転移もない患者(HADS 平均 8 点)で、3ヵ月後、6ヵ月、12ヵ月後の HADS 得点が 14 点以上に悪化したか、大うつ病や適応障害のうつ状態を発症し精神科を受診した 12 症例と、初回、3ヵ月後、6ヵ月、12ヵ月後のHADS 得点がいずれも 13 点以下であった症例から無作為に抽出した 12 症例につき、再度同意を得なおした後に、悪化群 10 症例と未変化群 9 症例に半構造化面接を行うことができた。悪化群では大うつ病が 3 症例、適応障害が 7 症例であり、未変化群では精神科的診断はつかなかった。その悪化群 10 症例と未変化群9 症例とでの初回時の PET 画像の差異を SPM 解析した。
悪化群では悪化前から右上前頭回(BA6 野)の一部で FDG-PET でのグルコースの取り込みが低下していた。また、両側前部帯状回(BA25 野)と右後部帯状回では取り込みが悪化群ですでに増加していた。従来からうつ病患者の FDG-PET でのグルコース取り込み能が低下していると報告されることの多い両側中心前回のうち、右側での低下が悪化群では大うつ病や適応障害の精神症状の出現前からすでに認められていたことになる。しかし、内側前頭前野の BA10 野での低下は認められなかった。一方、同じ前頭葉内側面でもうつ病でグルコース取り込み能が増加していると報告されることの多い右帯状回での増加が悪化群では精神症状の出現前から認められていたことになる。
これらの脳部位の変化は発症前から存在し、発症脆弱性と関連する部位である可能性が示唆されるので、死後脳での細胞構築学的な解析が待たれる。これらの発症脆弱性を有するがん罹患者の多くが、中高年であることからおそらく微小脳血管障害がその基盤にある可能性が高いと推測される。
4。 まとめ
図 1 のように脳の発達期に形成される発症脆弱性と中高年以降の脳の退行期に形成される発症脆弱性とは全く別のものである可能性があるが、ストレスが作用してうつ病が発症する時には、その脆弱性が形成された部位ならびにそれとリンクする別の脳部位の機能が広範に変動し、うつ病の病態が脳内に形成されると考えられる。このストレスの作用には HPA 系のフィードバック機能の軽微な低下という脆弱性も関与している可能性がある。これらの研究がもっと発展すると、種々の検査で、うつ病にかかりやすいかどうかが前もってわかるようになり、うつ病の発症を予防することができるようになると期待される。
-----
HPA 系の話はしばしば出てくるのであるが、それではそれをどのように治療に応用したらよいのかという観点ではあまり頭のいい提案はないように思う。上の話も、結局はHPA 系はセロトニンに関係していると主張して、逃げているし、そのあとの色々については直観的によく納得ができるような性質のものでもない。
「脆弱性が形成された部位ならびにそれとリンクする別の脳部位の機能が広範に変動し、うつ病の病態が脳内に形成されると考えられる」という話は、何も新しい情報をもたらしていない。つまり、分かりませんというのと同じだ。

